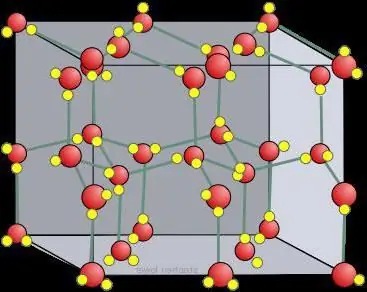
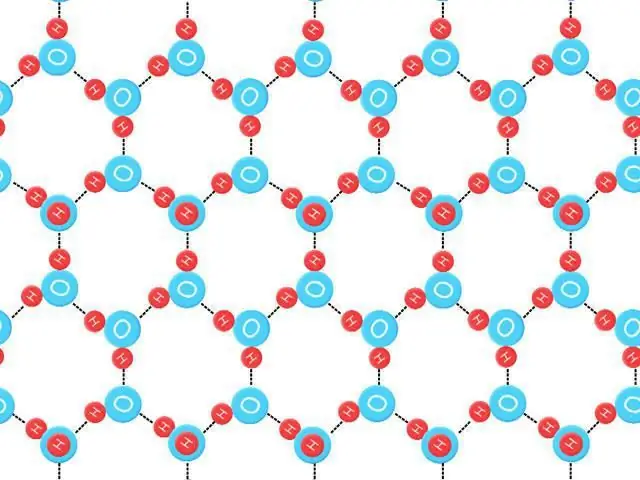
Den tredimensjonale tilstanden til flytende vann er vanskelig å studere, men mye har blitt lært ved å analysere strukturen til iskrystaller. Fire tilstøtende hydrogen-interagerende oksygenatomer okkuperer toppunktene til et tetraeder (tetra=fire, hedron=plan). Den gjennomsnittlige energien som kreves for å bryte en slik binding i is, er beregnet til 23 kJ/mol-1.

Vannmolekylers evne til å danne et gitt antall hydrogenkjeder, samt en gitt styrke, skaper et uvanlig høyt smeltepunkt. Når det smelter, holdes det av flytende vann, hvis struktur er uregelmessig. De fleste av hydrogenbindingene er forvrengt. Det kreves en stor mengde energi i form av varme for å bryte krystallgitteret til hydrogenbundet is.
Funksjoner ved utseendet til is (Ih)
Mange av innbyggerne lurer på hva slags krystallgitter is har. NødvendigDet skal bemerkes at tettheten til de fleste stoffer øker under frysing, når molekylære bevegelser bremser ned og tettpakkede krystaller dannes. Vannets tetthet øker også når det avkjøles til et maksimum ved 4°C (277K). Deretter, når temperaturen faller under denne verdien, utvides den.
Denne økningen skyldes dannelsen av en åpen, hydrogenbundet iskrystall med gitter og lavere tetthet, der hvert vannmolekyl er stivt bundet av elementet ovenfor og fire andre verdier, mens de beveger seg raskt nok til å ha mer masse. Siden denne handlingen skjer, fryser væsken fra topp til bunn. Dette har viktige biologiske resultater, som et resultat av at islaget på dammen isolerer levende vesener bort fra ekstrem kulde. I tillegg er to tilleggsegenskaper til vann relatert til dets hydrogenegenskaper: spesifikk varme og fordampning.
Detaljert beskrivelse av strukturer
Det første kriteriet er mengden som trengs for å øke temperaturen på 1 gram av et stoff med 1°C. Å øke vanngradene krever relativt mye varme fordi hvert molekyl er involvert i en rekke hydrogenbindinger som må brytes for at den kinetiske energien skal øke. For øvrig betyr overflod av H2O i cellene og vevet til alle store flercellede organismer at temperatursvingninger inne i cellene minimeres. Denne funksjonen er avgjørende, siden frekvensen av de fleste biokjemiske reaksjonersensitiv.
Fordampningsvarmen til vann er også betydelig høyere enn for mange andre væsker. Det kreves en stor mengde varme for å omdanne denne kroppen til en gass, fordi hydrogenbindingene må brytes for at vannmolekylene skal løsne fra hverandre og gå inn i nevnte fase. Foranderlige legemer er permanente dipoler og kan samhandle med andre lignende forbindelser og de som ioniserer og løses opp.
Andre stoffer nevnt ovenfor kan bare komme i kontakt hvis polaritet er tilstede. Det er denne forbindelsen som er involvert i strukturen til disse elementene. I tillegg kan den rette seg rundt disse partiklene dannet av elektrolytter, slik at de negative oksygenatomene i vannmolekylene er orientert mot kationene, og de positive ionene og hydrogenatomene er orientert mot anionene.
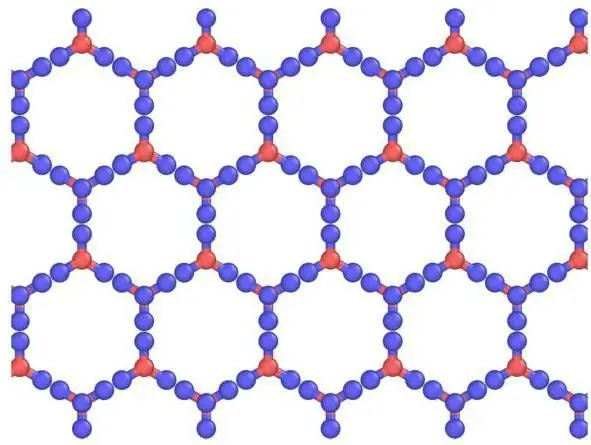
I faste stoffer dannes som regel molekylære krystallgitter og atomære. Det vil si at hvis jod er bygget på en slik måte at det inneholder I2, , så er CO2 molekyler i fast karbondioksid, det vil si i tørris. plassert ved krystallgitternodene . Ved interaksjon med lignende stoffer har is et ionisk krystallgitter. Grafitt, for eksempel, som har en atomstruktur basert på karbon, er ikke i stand til å endre den, akkurat som diamant.
Hva skjer når en krystall av bords alt løses opp i vann: polare molekyler tiltrekkes av ladede elementer i krystallen, noe som fører til dannelsen av lignende partikler av natrium og klorid på overflaten, noe som resulterer i disse kroppeneblir forskjøvet fra hverandre, og det begynner å løse seg opp. Herfra kan det observeres at is har et krystallgitter med ionisk binding. Hver oppløst Na + tiltrekker de negative endene av flere vannmolekyler, mens hver oppløst Cl - tiltrekker de positive endene. Skallet som omgir hvert ion kalles rømningssfæren og inneholder vanligvis flere lag med løsemiddelpartikler.
Tørriskrystallgitter
Variabler eller et ion omgitt av grunnstoffer sies å være sulfatert. Når løsningsmidlet er vann, blir slike partikler hydrert. Dermed har ethvert polart molekyl en tendens til å bli solvatisert av elementene i væskelegemet. I tørris danner typen krystallgitter atombindinger i aggregeringstilstanden, som er uendret. En annen ting er krystallinsk is (frossent vann). Ioniske organiske forbindelser som karboksylase og protonerte aminer må være løselige i hydroksyl- og karbonylgrupper. Partiklene i slike strukturer beveger seg mellom molekyler, og deres polare systemer danner hydrogenbindinger med denne kroppen.
Selvfølgelig påvirker antallet av de sist angitte gruppene i et molekyl dets løselighet, som også avhenger av reaksjonen til ulike strukturer i grunnstoffet: for eksempel en-, to- og trekarbonalkoholer er blandbare med vann, men større hydrokarboner med enkle hydroksylforbindelser er mye mindre fortynnet i væsker.
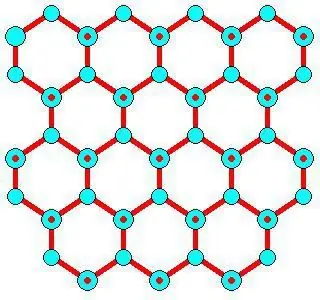
Hexagonal Ih ligner i formen påatomisk krystallgitter. For is og all naturlig snø på jorden ser det akkurat slik ut. Dette er bevist av symmetrien til krystallgitteret av is, dyrket fra vanndamp (det vil si snøflak). Den er i romgruppe P 63/mm fra 194; D 6h, Laue klasse 6/mm; ligner på β-, som har et multiplum av 6 spiralakser (rotasjon rundt i tillegg til å skifte langs den). Den har en ganske åpen struktur med lav tetthet hvor effektiviteten er lav (~1/3) sammenlignet med enkle kubiske (~1/2) eller ansiktssentrerte kubiske (~3/4) strukturer.
Sammenlignet med vanlig is, er krystallgitteret til tørris, bundet av CO2-molekyler, statisk og endres bare når atomer forfaller.
Beskrivelse av gitter og deres elementer
Krystaller kan sees på som krystallinske modeller, bestående av ark plassert over hverandre. Hydrogenbindingen er ordnet, mens den i realiteten er tilfeldig, siden protoner kan bevege seg mellom vann(is)molekyler ved temperaturer over ca. 5 K. Det er faktisk sannsynlig at protoner oppfører seg som en kvantevæske i en konstant tunnelstrøm. Dette forsterkes av spredningen av nøytroner, som viser spredningstettheten deres halvveis mellom oksygenatomene, noe som indikerer lokalisering og samordnet bevegelse. Her er det en likhet mellom is og et atomært, molekylært krystallgitter.
Molekyler har et forskjøvet arrangement av hydrogenkjedenmed hensyn til sine tre naboer i flyet. Det fjerde elementet har et formørket hydrogenbindingsarrangement. Det er et lite avvik fra perfekt heksagonal symmetri, da enhetscellen er 0,3 % kortere i retning av denne kjeden. Alle molekyler opplever de samme molekylære miljøene. Det er nok plass inne i hver "boks" til å holde partikler av interstitielt vann. Selv om de ikke generelt vurderes, har de nylig blitt detektert effektivt ved nøytrondiffraksjon av det pulveraktige krystallgitteret av is.
Changing Substances
Den sekskantede kroppen har trippelpunkter med flytende og gassformig vann 0,01 ° C, 612 Pa, faste elementer - tre -21,985 ° C, 209,9 MPa, elleve og to -199,8 ° C, 70 MPa, samt - 34,7 °C, 212,9 MPa. Den dielektriske konstanten til sekskantet is er 97,5.
Smeltekurven til dette elementet er gitt av MPa. Tilstandsligningene er tilgjengelige, i tillegg til dem, noen enkle ulikheter knyttet til endringen i fysiske egenskaper til temperaturen på sekskantet is og dens vandige suspensjoner. Hardheten svinger med grader som stiger fra eller under gips (≦2) ved 0°C til feltspat (6 Mohs) ved -80°C, en unorm alt stor endring i absolutt hardhet (> 24 ganger).
Det sekskantede krystallgitteret av is danner sekskantede plater og søyler, der de øvre og nedre flatene er basalplanene {0 0 0 1} med en entalpi på 5,57 μJ cm -2, og andre ekvivalente sidedeler kalles deler av prismet {1 0 -1 0} med 5, 94µJ cm -2. Sekundærflater {1 1 -2 0} med 6,90 ΜJ ˣ cm -2 kan dannes langs planene som dannes av sidene av strukturene.
En slik struktur viser en unormal nedgang i termisk ledningsevne med økende trykk (samt kubisk og amorf is med lav tetthet), men skiller seg fra de fleste krystaller. Dette skyldes en endring i hydrogenbindingen, som reduserer den tverrgående lydhastigheten i krystallgitteret til is og vann.
Det finnes metoder som beskriver hvordan man forbereder store krystallprøver og hvilken som helst isoverflate. Det antas at hydrogenbindingen på overflaten av den sekskantede kroppen som studeres vil være mer ordnet enn inne i bulksystemet. Variasjonsspektroskopi med fasegitterfrekvensgenerering har vist at det er en strukturell asymmetri mellom de to øvre lagene (L1 og L2) i den underjordiske HO-kjeden til den basale overflaten av sekskantet is. De adopterte hydrogenbindingene i de øvre lagene av sekskantene (L1 O ··· HO L2) er sterkere enn de som aksepteres i det andre laget til den øvre akkumuleringen (L1 OH ··· O L2). Interaktive sekskantede isstrukturer tilgjengelig.
Utviklingsfunksjoner
Minste antall vannmolekyler som trengs for å danne is er omtrent 275 ± 25, som for en komplett ikosaedrisk klynge på 280. Dannelse skjer med en hastighet på 10 10 ved luft-vann-grensesnitt og ikke i bulkvann. Veksten av iskrystaller avhenger av ulike veksthastigheter av ulikeenergier. Vann må beskyttes mot frysing ved kryokonservering av biologiske prøver, mat og organer.
Dette oppnås vanligvis ved raske avkjølingshastigheter, ved å bruke små prøver og en kryokonservator, og øke trykket for å danne iskjerner og forhindre celleskade. Den frie energien til is/væske øker fra ~30 mJ/m2 ved atmosfærisk trykk til 40 mJ/m-2 ved 200 MPa, noe som indikerer grunnen til at denne effekten oppstår.
Hvilken type krystallgitter er karakteristisk for is
Alternativt kan de vokse raskere fra prismeoverflater (S2), på den tilfeldig forstyrrede overflaten til hurtigfrosne eller agiterte innsjøer. Veksten fra {1 1 -2 0}-flatene er minst den samme, men gjør dem til prismebaser. Dataene om utviklingen av iskrystallen er fullstendig undersøkt. Den relative veksthastigheten for elementer av forskjellige ansikter avhenger av evnen til å danne en stor grad av leddhydrering. Temperaturen (lav) på vannet rundt bestemmer graden av forgrening i iskrystallen. Partikkelvekst begrenses av diffusjonshastigheten ved lav grad av underkjøling, dvs. <2 °C, noe som resulterer i flere av dem.

Men begrenset av utviklingskinetikk ved høyere nivåer av depresjon på >4°C, noe som resulterer i nålevekst. Denne formen ligner strukturen til tørris (har et krystallgitter med en sekskantet struktur), ulikeegenskaper ved overflateutvikling og temperaturen til det omkringliggende (superkjølte) vannet, som ligger bak snøflakens flate former.
Dannelsen av is i atmosfæren påvirker dannelsen og egenskapene til skyer dypt. Feltspat, funnet i ørkenstøv som kommer inn i atmosfæren i millioner av tonn per år, er viktige former. Datasimuleringer har vist at dette skyldes kjernedannelse av prismatiske iskrystallplan på overflateplan med høy energi.
Noen andre elementer og gitter
Oppløste stoffer (med unntak av svært lite helium og hydrogen, som kan komme inn i mellomrommene) kan ikke inkluderes i Ih-strukturen ved atmosfærisk trykk, men presses ut til overflaten eller det amorfe laget mellom partiklene i mikrokrystallinsk kropp. Det er noen andre elementer på gitterstedene for tørris: kaotropiske ioner som NH4 + og Cl - som inngår i lettere flytende frysing enn andre kosmotrope som Na + og SO42-, så å fjerne dem er ikke mulig på grunn av at de danner en tynn film av den gjenværende væsken mellom krystallene. Dette kan føre til elektrisk ladning av overflaten på grunn av dissosiasjon av overflatevann som balanserer de gjenværende ladningene (som også kan føre til magnetisk stråling) og en endring i pH til de resterende væskefilmene, f.eks. NH 42SO4 blir surere og NaCl blir mer basisk.
De er vinkelrett på ansiktenekrystallgitter av is som viser neste lag festet (med O-atomer i svart). De er preget av en sakte voksende basaloverflate {0 0 0 1}, hvor kun isolerte vannmolekyler er festet. En raskt voksende {1 0 -1 0} overflate av et prisme der par av nylig festede partikler kan binde seg til hverandre med hydrogen (en hydrogenbinding/to molekyler av et grunnstoff). Det raskest voksende ansiktet er {1 1 -2 0} (sekundær prismatisk), der kjeder av nylig festede partikler kan samhandle med hverandre ved hydrogenbinding. En av hennes kjeder/elementmolekyler er en form som danner rygger som deler seg og oppmuntrer til transformasjon til to sider av prismet.
Nullpunktentropi
Kan defineres som S 0=k B ˣ Ln (N E0), hvor k B er Boltzmann-konstanten, NE er antall konfigurasjoner ved energien E, og E0 er den laveste energien. Denne verdien for entropien til sekskantet is ved null Kelvin bryter ikke termodynamikkens tredje lov "Entropien til en ideell krystall ved absolutt null er nøyaktig null", siden disse elementene og partiklene ikke er ideelle, har uordnet hydrogenbinding.
I denne kroppen er hydrogenbindingen tilfeldig og endres raskt. Disse strukturene er ikke nøyaktig like i energi, men strekker seg til et veldig stort antall energisk nære tilstander, adlyder "isens regler". Nullpunktentropi er lidelsen som ville forbli selv om materialet kunne avkjøles til absoluttnull (0 K=-273, 15 °C). Genererer eksperimentell forvirring for sekskantet is 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoretisk sett vil det være mulig å beregne null-entropien til kjente iskrystaller med mye større nøyaktighet (forsømmer defekter og energinivåspredning) enn å bestemme den eksperimentelt.
Forskere og deres arbeid på dette området
Kan defineres som S 0=k B ˣ Ln (N E0), hvor k B er Boltzmann-konstanten, NE er antall konfigurasjoner ved energien E, og E0 er den laveste energien. Denne verdien for entropien til sekskantet is ved null Kelvin bryter ikke termodynamikkens tredje lov "Entropien til en ideell krystall ved absolutt null er nøyaktig null", siden disse elementene og partiklene ikke er ideelle, har uordnet hydrogenbinding.
I denne kroppen er hydrogenbindingen tilfeldig og endres raskt. Disse strukturene er ikke nøyaktig like i energi, men strekker seg til et veldig stort antall energisk nære tilstander, adlyder "isens regler". Nullpunktentropi er forstyrrelsen som ville forbli selv om materialet kunne kjøles ned til absolutt null (0 K=-273,15°C). Genererer eksperimentell forvirring for sekskantet is 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoretisk sett vil det være mulig å beregne null-entropien til kjente iskrystaller med mye større nøyaktighet (forsømmer defekter og energinivåspredning) enn å bestemme den eksperimentelt.

Selv om rekkefølgen av protoner i bulk-is ikke er ordnet, foretrekker overflaten sannsynligvis rekkefølgen til disse partiklene i form av bånd av hengende H-atomer og O-enkeltpar (null entropi med ordnede hydrogenbindinger). Nullpunktforstyrrelsen ZPE, J ˣ mol -1 ˣ K -1 og andre er funnet. Fra alt det ovenstående er det klart og forståelig hvilke typer krystallgitter som er karakteristiske for is.






