Verden vi lever i er ufattelig vakker og full av mange forskjellige prosesser som setter livets kurs. Alle disse prosessene studeres av den kjente vitenskapen - fysikk. Det gir en mulighet til å få i det minste en ide om opprinnelsen til universet. I denne artikkelen vil vi vurdere et slikt konsept som molekylær kinetisk teori, dens ligninger, typer og formler. Men før du går videre til en dypere studie av disse spørsmålene, må du avklare selve betydningen av fysikk og områdene den studerer.
Hva er fysikk?

Faktisk er dette en veldig omfattende vitenskap og kanskje en av de mest grunnleggende i menneskehetens historie. For eksempel, hvis den samme informatikk er assosiert med nesten alle områder av menneskelig aktivitet, enten det er beregningsdesign eller skapelse av tegneserier, så er fysikk selve livet, en beskrivelse av dets komplekse prosesser og flyter. La oss prøve å finne betydningen, forenkle forståelsen så mye som mulig.
SåDermed er fysikk en vitenskap som omhandler studiet av energi og materie, forbindelsene mellom dem, forklaringen på mange prosesser som skjer i vårt enorme univers. Den molekylær-kinetiske teorien om materiens struktur er bare en liten dråpe i havet av teorier og grener av fysikk.
Energi, som denne vitenskapen studerer i detalj, kan representeres i en rekke former. For eksempel i form av lys, bevegelse, gravitasjon, stråling, elektrisitet og mange andre former. Vi vil i denne artikkelen berøre den molekylære kinetiske teorien om strukturen til disse formene.
Studien av materie gir oss en ide om materiens atomstruktur. Det følger forresten av den molekylær-kinetiske teorien. Vitenskapen om materiens struktur lar oss forstå og finne meningen med vår eksistens, årsakene til livets fremvekst og selve universet. La oss fortsatt prøve å studere den molekylære kinetiske teorien om materie.
For det første er det nødvendig med en introduksjon for å forstå terminologien og eventuelle konklusjoner fullt ut.
fysikkemner
Når man svarer på spørsmålet om hva molekylær-kinetisk teori er, kan man ikke annet enn å snakke om deler av fysikken. Hver av disse omhandler den detaljerte studien og forklaringen av et bestemt område av menneskelivet. De er klassifisert som følger:
- Mekanikk, som er delt inn i ytterligere to seksjoner: kinematikk og dynamikk.
- Static.
- Termodynamikk.
- Molecular section.
- elektrodynamikk.
- Optikk.
- Kvanternes fysikk og atomkjernen.
La oss snakke spesifikt om molekylærtfysikk, fordi den er basert på den molekylær-kinetiske teorien.
Hva er termodynamikk?
Generelt er den molekylære delen og termodynamikken nært beslektede grener av fysikken, som utelukkende studerer den makroskopiske komponenten av det totale antallet fysiske systemer. Det er verdt å huske at disse vitenskapene beskriver nøyaktig den indre tilstanden til kropper og stoffer. For eksempel deres tilstand under oppvarming, krystallisering, fordamping og kondensasjon, på atomnivå. Molekylærfysikk er med andre ord vitenskapen om systemer som består av et stort antall partikler: atomer og molekyler.
Det var disse vitenskapene som studerte hovedbestemmelsene til den molekylære kinetiske teorien.
Selv i løpet av sjuende klasse ble vi kjent med begrepene mikro- og makroverdener, systemer. Det vil ikke være overflødig å oppdatere disse termene i minnet.
Mikroverdenen, som vi kan se av navnet, består av elementærpartikler. Dette er med andre ord de små partiklers verden. Størrelsene deres er målt i området fra 10-18 m til 10-4 m, og tiden for deres faktiske tilstand kan nå både uendelig og uforholdsmessig små intervaller, for eksempel 10-20 s.
Macroworld vurderer kropper og systemer med stabile former, bestående av mange elementærpartikler. Slike systemer står i forhold til vår menneskelige størrelse.
I tillegg er det noe slikt som en megaverden. Den består av enorme planeter, kosmiske galakser og komplekser.
Grunnleggendeteori
Nå som vi har oppsummert litt og husket de grunnleggende begrepene i fysikk, kan vi gå direkte til hovedemnet i denne artikkelen.
Molekylærkinetisk teori dukket opp og ble formulert for første gang på 1800-tallet. Dens essens ligger i det faktum at den i detalj beskriver strukturen til ethvert stoff (oftere strukturen til gasser enn faste og flytende legemer), basert på tre grunnleggende bestemmelser som ble samlet inn fra antakelsene til så fremtredende forskere som Robert Hooke, Isaac Newton, Daniel Bernoulli, Mikhail Lomonosov og mange andre.
Hovedbestemmelsene i den molekylære kinetiske teorien høres slik ut:
- Absolutt alle stoffer (uansett om de er flytende, faste eller gassformige) har en kompleks struktur, bestående av mindre partikler: molekyler og atomer. Atomer kalles noen ganger "elementære molekyler".
- Alle disse elementærpartiklene er alltid i en tilstand av kontinuerlig og kaotisk bevegelse. Hver av oss har kommet over et direkte bevis på dette forslaget, men har mest sannsynlig ikke lagt stor vekt på det. For eksempel så vi alle på bakgrunn av solstrålene at støvpartikler hele tiden beveger seg i en kaotisk retning. Dette skyldes det faktum at atomene produserer gjensidige dytt med hverandre, og konstant gir kinetisk energi til hverandre. Dette fenomenet ble først studert i 1827, og det ble oppk alt etter oppdageren - "Brownian motion".
- Alle elementærpartikler er i ferd med kontinuerlig interaksjon med hverandre medvisse krefter som har en elektrisk stein.
Det er verdt å merke seg at et annet eksempel som beskriver posisjon nummer to, som også kan gjelde for eksempel for den molekylære kinetiske teorien om gasser, er diffusjon. Vi møter det i hverdagen, og i flere tester og kontroller, så det er viktig å ha en idé om det.
Vurder først følgende eksempler:
Legen sølt alkohol ved et uhell fra en kolbe på bordet. Eller kanskje du mistet parfymeflasken og den spredte seg over hele gulvet.
Hvorfor, i disse to tilfellene, vil både lukten av alkohol og lukten av parfyme fylle hele rommet etter en tid, og ikke bare området der innholdet av disse stoffene ble sølt?
Svaret er enkelt: diffusjon.
Diffusjon - hva er det? Hvordan flyter det?

Dette er en prosess der partiklene som utgjør ett bestemt stoff (vanligvis en gass) trenger inn i de intermolekylære hulrommene til et annet. I eksemplene ovenfor skjedde følgende: på grunn av termisk, det vil si kontinuerlig og dissosiert bevegelse, f alt alkohol- og/eller parfymemolekyler inn i hullene mellom luftmolekylene. Gradvis, under påvirkning av kollisjon med atomer og luftmolekyler, spredte de seg rundt i rommet. Forresten, intensiteten av diffusjon, det vil si hastigheten på dens strømning, avhenger av tettheten til stoffene som er involvert i diffusjon, så vel som av bevegelsesenergien til deres atomer og molekyler, k alt kinetisk. Jo større kinetisk energi, jo høyere hastighet er henholdsvis disse molekylene og intensiteten.
Den raskeste diffusjonsprosessen kan kalles diffusjon i gasser. Dette skyldes det faktum at gassen ikke er homogen i sin sammensetning, noe som betyr at intermolekylære hulrom i gasser opptar en betydelig mengde plass, henholdsvis, og prosessen med å få inn atomer og molekyler av et fremmed stoff i dem går lettere og raskere.
Denne prosessen er litt tregere i væsker. Oppløsningen av sukkerbiter i et krus te er bare et eksempel på diffusjon av et fast stoff i en væske.
Men den lengste tiden er diffusjon i legemer med en solid krystallinsk struktur. Dette er nøyaktig slik, fordi strukturen til faste stoffer er homogen og har et sterkt krystallgitter, i cellene som atomene til det faste stoffet vibrerer. Hvis for eksempel overflatene til to metallstenger rengjøres godt og deretter bringes i kontakt med hverandre, vil vi etter tilstrekkelig lang tid kunne oppdage deler av det ene metallet i det andre, og omvendt.
Som alle andre grunnleggende seksjoner, er den grunnleggende teorien om fysikk delt inn i separate deler: klassifisering, typer, formler, ligninger, og så videre. Dermed har vi lært det grunnleggende om molekylær kinetisk teori. Dette betyr at du trygt kan gå videre til vurderingen av individuelle teoretiske blokker.
Molekylærkinetisk teori om gasser
Det er behov for å forstå bestemmelsene i gassteorien. Som vi sa tidligere, vil vi vurdere de makroskopiske egenskapene til gasser, som trykk og temperatur. Dette ervil være nødvendig senere for å utlede ligningen for den molekylær-kinetiske teorien om gasser. Men matematikk - senere, og nå, la oss ta for oss teori og følgelig fysikk.
Forskere har formulert fem bestemmelser i den molekylære teorien om gasser, som tjener til å forstå den kinetiske modellen for gasser. De høres slik ut:
- Alle gasser er bygd opp av elementærpartikler som ikke har en viss størrelse, men som har en viss masse. Med andre ord er volumet av disse partiklene minim alt sammenlignet med lengden mellom dem.
- Atomer og molekyler av gasser har praktisk t alt ingen potensiell energi, henholdsvis i henhold til loven er all energi lik kinetisk.
- Vi ble allerede kjent med denne posisjonen tidligere - Brownsk bevegelse. Det vil si at gasspartikler alltid er i kontinuerlig og kaotisk bevegelse.
- Absolutt alle gjensidige kollisjoner av gasspartikler, akkompagnert av budskapet om hastighet og energi, er helt elastiske. Dette betyr at det ikke er noe tap av energi eller skarpe hopp i kinetisk energi under en kollisjon.
- Under normale forhold og konstant temperatur er den gjennomsnittlige energien for partikkelbevegelse for nesten alle gasser den samme.
Vi kan omskrive den femte posisjonen gjennom denne typen ligning av den molekylær-kinetiske teorien om gasser:
E=1/2mv^2=3/2kT, der k er Boltzmann-konstanten; T - temperatur i Kelvin.
Denne ligningen får oss til å forstå sammenhengen mellom hastigheten til elementærpartikler av gass og deres absolutte temperatur. Følgelig, jo høyere er deres absoluttetemperatur, jo høyere hastighet og kinetisk energi.
Gasspress
Slike makroskopiske komponenter av karakteristikken, for eksempel trykket til gasser, kan også forklares ved hjelp av den kinetiske teorien. For å gjøre dette, la oss forestille oss følgende eksempel.
La oss anta at et molekyl av en eller annen gass er i en boks, hvis lengde er L. La oss bruke bestemmelsene i gassteorien beskrevet ovenfor og ta hensyn til det faktum at molekylsfæren bare beveger seg langs x-en. -akser. Dermed vil vi kunne observere prosessen med elastisk kollisjon med en av veggene i fartøyet (boksen).
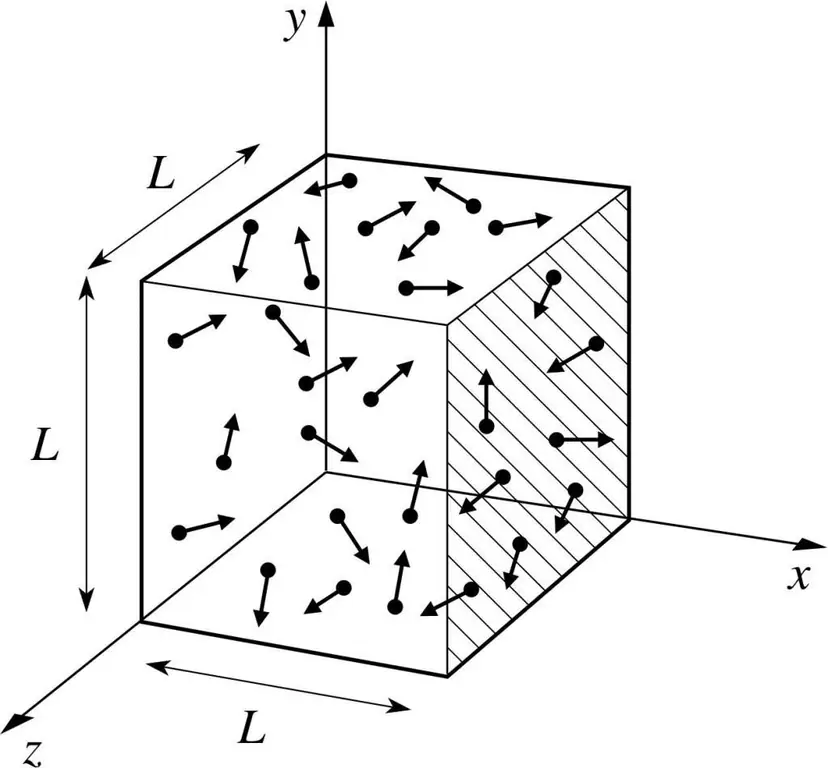
Momentumet til den pågående kollisjonen, som vi vet, bestemmes av formelen: p=mv, men i dette tilfellet vil denne formelen ha en projeksjonsform: p=mv(x).
Siden vi kun vurderer dimensjonen til x-aksen, det vil si x-aksen, vil den totale endringen i momentum uttrykkes med formelen: mv(x) - m(-v(x))=2mv(x).
Vurder deretter kraften som utøves av objektet vårt ved å bruke Newtons andre lov: F=ma=P/t.
Fra disse formlene uttrykker vi trykket fra gasssiden: P=F/a;
La oss nå erstatte kraftuttrykket i den resulterende formelen og få: P=mv(x)^2/L^3.
Etter det kan vår ferdige trykkformel skrives for det N-te antallet gassmolekyler. Med andre ord, det vil se slik ut:
P=Nmv(x)^2/V, der v er hastighet og V er volum.
La oss nå prøve å fremheve noen grunnleggende bestemmelser om gasstrykk:
- Det manifesterer seg gjennomkollisjoner av molekyler med molekyler i veggene til objektet det befinner seg i.
- Størrelsen på trykket er direkte proporsjonal med kraften og hastigheten til molekylers innvirkning på veggene til fartøyet.
Noen korte konklusjoner om teori
Før vi går videre og vurderer den grunnleggende ligningen for molekylær kinetisk teori, tilbyr vi deg noen korte konklusjoner fra punktene og teorien ovenfor:
- Målet for den gjennomsnittlige bevegelsesenergien til dets atomer og molekyler er den absolutte temperaturen.
- Når to forskjellige gasser har samme temperatur, har molekylene deres samme gjennomsnittlige kinetiske energi.
- Energien til gasspartikler er direkte proporsjonal med den gjennomsnittlige kvadrathastigheten: E=1/2mv^2.
- Selv om gassmolekyler har henholdsvis en gjennomsnittlig kinetisk energi og en gjennomsnittlig hastighet, beveger individuelle partikler seg med forskjellige hastigheter: noen raske, noen sakte.
- Jo høyere temperatur, desto høyere hastighet har molekylene.
- Hvor mange ganger vi øker temperaturen på gassen (for eksempel dobles), øker bevegelsesenergien til partiklene like mange ganger (henholdsvis dobles).
Grunnleggende ligning og formler

Den grunnleggende ligningen for den molekylære kinetiske teorien lar deg etablere forholdet mellom mengdene i mikroverdenen og følgelig de makroskopiske, det vil si målte, mengdene.
En av de enkleste modellene som molekylær teori kan vurdere, er den ideelle gassmodellen.
Du kan si detdette er en slags imaginær modell studert av den molekylære kinetiske teorien om en ideell gass, der:
- de enkleste gasspartiklene betraktes som perfekt elastiske kuler som interagerer både med hverandre og med molekylene i veggene til ethvert fartøy i bare ett tilfelle - en absolutt elastisk kollisjon;
- attraksjonskreftene inne i gassen er fraværende, eller de kan faktisk bli neglisjert;
- elementer i den indre strukturen til gassen kan tas som materielle punkter, det vil si at volumet deres også kan neglisjeres.
Med tanke på en slik modell skrev den tyskfødte fysikeren Rudolf Clausius en formel for gasstrykk gjennom forholdet mellom mikro- og makroskopiske parametere. Det ser ut som:
p=1/3m(0)nv^2.
Senere vil denne formelen bli k alt som den grunnleggende ligningen for den molekylær-kinetiske teorien om en ideell gass. Den kan presenteres i flere forskjellige former. Vår plikt nå er å vise seksjoner som molekylfysikk, molekylær kinetisk teori, og derav deres komplette ligninger og typer. Derfor er det fornuftig å vurdere andre varianter av den grunnleggende formelen.
Vi vet at den gjennomsnittlige energien som karakteriserer bevegelsen til gassmolekyler kan finnes ved å bruke formelen: E=m(0)v^2/2.
I dette tilfellet kan vi erstatte uttrykket m(0)v^2 i den opprinnelige trykkformelen med gjennomsnittlig kinetisk energi. Som et resultat av dette vil vi få muligheten til å komponere den grunnleggende ligningen for den molekylære kinetiske teorien for gasser i følgende form: p=2/3nE.
Dessuten vet vi alle at uttrykket m(0)n kan skrives som et produkt av to kvotienter:
m/NN/V=m/V=ρ.
Etter disse manipulasjonene kan vi omskrive formelen vår for ligningen for den molekylær-kinetiske teorien om en ideell gass i en tredje, annen form:
p=1/3ρv^2.
Vel, kanskje det er alt du trenger å vite om dette emnet. Det gjenstår bare å systematisere kunnskapen som er oppnådd i form av korte (og ikke så) konklusjoner.
Alle generelle konklusjoner og formler om emnet "Molekylær-kinetisk teori"
Så la oss komme i gang.
Først:
Fysikk er en grunnleggende vitenskap inkludert i løpet av naturvitenskap, som studerer egenskapene til materie og energi, deres struktur, mønstre av uorganisk natur.
Den inkluderer følgende seksjoner:
- mekanikk (kinematikk og dynamikk);
- static;
- termodynamikk;
- elektrodynamikk;
- molekylær seksjon;
- optikk;
- fysikk av kvanter og atomkjernen.
Second:
Partikkelfysikk og termodynamikk er nært beslektede grener som studerer den utelukkende makroskopiske komponenten av det totale antallet fysiske systemer, det vil si systemer som består av et stort antall elementærpartikler.
De er basert på molekylær kinetisk teori.
Tredje:
Kjernen i saken er dette. Den molekylære kinetiske teorien beskriver i detalj strukturen til et stoff (oftere strukturen til gasser enn faste stoffer).og flytende legemer), basert på tre grunnleggende forutsetninger som ble samlet inn fra antakelsene til fremtredende forskere. Blant dem: Robert Hooke, Isaac Newton, Daniel Bernoulli, Mikhail Lomonosov og mange andre.
Fjerde:
Tre grunnleggende prinsipper for molekylær kinetisk teori:
- Alle stoffer (uansett om de er flytende, faste eller gassformige) har en kompleks struktur som består av mindre partikler: molekyler og atomer.
- Alle disse enkle partiklene er i kontinuerlig kaotisk bevegelse. Eksempel: Brownsk bevegelse og diffusjon.
- Alle molekyler under alle forhold samhandler med hverandre med visse krefter som har en elektrisk bergart.
Hver av disse bestemmelsene i den molekylære kinetiske teorien er et solid fundament i studiet av materiens struktur.
Femte:
Flere hovedpunkter i molekylær teori for gassmodellen:
- Alle gasser er bygd opp av elementærpartikler som ikke har en viss størrelse, men som har en viss masse. Med andre ord er volumet til disse partiklene minim alt sammenlignet med avstandene mellom dem.
- Atomer og molekyler av gasser har praktisk t alt ingen potensiell energi, henholdsvis deres totale energi er lik den kinetiske.
- Vi ble allerede kjent med denne posisjonen tidligere - Brownsk bevegelse. Det vil si at gasspartikler alltid er i kontinuerlig og tilfeldig bevegelse.
- Absolutt alle gjensidige kollisjoner av atomer og molekyler av gasser, ledsaget av budskapet om hastighet og energi, er fullstendig elastiske. Dette erbetyr at det ikke er noe tap av energi eller skarpe hopp i kinetisk energi under en kollisjon.
- Under normale forhold og konstant temperatur er den gjennomsnittlige kinetiske energien til nesten alle gasser den samme.
Sixth:
Konklusjoner fra teorien om gasser:
- Absolutt temperatur er et mål på den gjennomsnittlige kinetiske energien til atomene og molekylene.
- Når to forskjellige gasser har samme temperatur, har molekylene deres samme gjennomsnittlige kinetiske energi.
- Den gjennomsnittlige kinetiske energien til gasspartikler er direkte proporsjonal med rotens gjennomsnittlige kvadrathastighet: E=1/2mv^2.
- Selv om gassmolekyler har henholdsvis en gjennomsnittlig kinetisk energi og en gjennomsnittlig hastighet, beveger individuelle partikler seg med forskjellige hastigheter: noen raske, noen sakte.
- Jo høyere temperatur, desto høyere hastighet har molekylene.
- Hvor mange ganger vi øker temperaturen på gassen (for eksempel dobles), øker den gjennomsnittlige kinetiske energien til partiklene også så mange ganger (henholdsvis dobles).
- Forholdet mellom trykket til en gass på veggene i fartøyet den befinner seg i og intensiteten av molekylers innvirkning på disse veggene er direkte proporsjonal: jo flere slag, jo høyere trykk, og omvendt.
Syvende:
En ideell gassmodell er en modell der følgende betingelser må oppfylles:
- Gassmolekyler kan og betraktes som perfekt elastiske kuler.
- Disse ballene kan samhandle med hverandre og med veggene til allefartøy i bare ett tilfelle - absolutt elastisk kollisjon.
- De kreftene som beskriver den gjensidige skyvekraften mellom atomer og molekyler i en gass er fraværende eller kan faktisk neglisjeres.
- Atomer og molekyler anses som materielle punkter, det vil si at volumet deres også kan neglisjeres.
åttende:
La oss gi alle de grunnleggende ligningene og vise formlene i emnet "Molekylær-kinetisk teori":
p=1/3m(0)nv^2 - den grunnleggende ligningen for den ideelle gassmodellen, utledet av den tyske fysikeren Rudolf Clausius.
p=2/3nE - den grunnleggende ligningen for den molekylær-kinetiske teorien om en ideell gass. Utledet fra den gjennomsnittlige kinetiske energien til molekylene.
р=1/3ρv^2 - samme ligning, men betraktet gjennom tettheten og rotens gjennomsnittlige kvadrathastighet til ideelle gassmolekyler.
m(0)=M/N(a) - formelen for å finne massen til ett molekyl gjennom Avogadro-tallet.
v^2=(v(1)+v(2)+v(3)+…)/N - formel for å finne gjennomsnittlig kvadrathastighet til molekyler, der v(1), v(2), v (3) og så videre - hastigheten til det første molekylet, det andre, det tredje og så videre opp til det n'te molekylet.
n=N/V - formel for å finne konsentrasjonen av molekyler, der N er antall molekyler i et gassvolum til et gitt volum V.
E=mv^2/2=3/2kT - formler for å finne den gjennomsnittlige kinetiske energien til molekyler, der v^2 er rotmiddelkvadrathastigheten til molekyler, k er en konstant verdi oppk alt etter østerrikeren, fysikken til Ludwig Boltzmann, og T er temperaturen på gassen.
p=nkT - trykkformel når det gjelder konsentrasjon, konstantBoltzmann og den absolutte temperaturen T. Fra den følger en annen grunnleggende formel, oppdaget av den russiske forskeren Mendeleev og den franske fysikeren-ingeniøren Claiperon:
pV=m/MRT, der R=kN(a) er den universelle konstanten for gasser.
La oss nå vise konstanter for forskjellige iso-prosesser: isobarisk, isokorisk, isotermisk og adiabatisk.
pV/T=const - utføres når massen og sammensetningen av gassen er konstant.
рV=konst - hvis temperaturen også er konstant.
V/T=konst - hvis gasstrykket er konstant.
p/T=konst - hvis volumet er konstant.
Kanskje det er alt du trenger å vite om dette emnet.
I dag stupte vi inn i et slikt vitenskapelig felt som teoretisk fysikk, dens mange seksjoner og blokker. Mer detaljert berørte vi et slikt område av fysikk som grunnleggende molekylfysikk og termodynamikk, nemlig molekylær-kinetisk teori, som, det ser ut til, ikke byr på noen vanskeligheter i den innledende studien, men faktisk har mange fallgruver.. Det utvider vår forståelse av den ideelle gassmodellen, som vi også studerte i detalj. I tillegg er det verdt å merke seg at vi også ble kjent med de grunnleggende ligningene for molekylær teori i deres forskjellige variasjoner, og også vurdert alle de mest nødvendige formlene for å finne visse ukjente mengder om dette emnet. Dette vil være spesielt nyttig når du forbereder å skrive eventuelle tester, undersøkelser og tester, eller for å utvide det generelle synet og kunnskapen om fysikk.
Vi håper at denne artikkelen var nyttig for deg, og du har hentet ut bare den mest nødvendige informasjonen fra den, noe som styrker kunnskapen din om slike pilarer innen termodynamikk som de grunnleggende bestemmelsene i molekylær kinetisk teori.






