Termodynamikk er en viktig gren av fysikk. Vi kan trygt si at dets prestasjoner har ført til fremveksten av den teknologiske æraen og i stor grad har bestemt løpet av menneskets historie de siste 300 årene. Artikkelen diskuterer termodynamikkens første, andre og tredje lov og deres anvendelse i praksis.
Hva er termodynamikk?
Før vi formulerer termodynamikkens lover, la oss finne ut hva denne delen av fysikk gjør.
Ordet "termodynamikk" er av gresk opprinnelse og betyr "bevegelse på grunn av varme". Det vil si at denne grenen av fysikk er engasjert i studiet av alle prosesser, som et resultat av hvilke termisk energi omdannes til mekanisk bevegelse og omvendt.
De grunnleggende lovene for termodynamikk ble formulert på midten av 1800-tallet. Vitenskapen om "bevegelse og varme" vurderer oppførselen til hele systemet som helhet, studerer endringen i dets makroskopiske parametere - temperatur, trykk og volum, og tar ikke hensyn til dets mikroskopiske struktur. Dessuten spiller den første av dem en grunnleggende rolle i utformingen av lovertermodynamikk i fysikk. Det er merkelig å merke seg at de utelukkende er avledet fra eksperimentelle observasjoner.
Konseptet med et termodynamisk system

Det betyr en hvilken som helst gruppe av atomer, molekyler eller andre grunnstoffer som anses som en helhet. Alle tre lovene er formulert for det såk alte termodynamiske systemet. Eksempler er: Jordens atmosfære, enhver levende organisme, gassblandingen i en forbrenningsmotor osv.
Alle systemer innen termodynamikk tilhører en av tre typer:
- Åpen. De utveksler både varme og materie med miljøet. For eksempel, hvis maten tilberedes i en gryte på åpen ild, så er dette et levende eksempel på et åpent system, siden gryten mottar energi fra det ytre miljøet (ild), mens den selv utstråler energi i form av varme, og vann fordamper også fra det (metabolisme)
- Stengt. I slike systemer er det ingen utveksling av materie med miljøet, selv om utveksling av energi skjer. Tilbake til forrige tilfelle: hvis du dekker vannkokeren med et lokk, kan du få et lukket system.
- Isolert. Dette er en slags termodynamiske systemer som ikke utveksler materie eller energi med det omkringliggende rommet. Et eksempel kan være en termos med varm te.
Termodynamisk temperatur

Dette konseptet betyr den kinetiske energien til partiklene som danner de omkringliggende kroppene, som reflekterer hastighetentilfeldig bevegelse av partikler. Jo større den er, jo høyere temperatur. Følgelig, ved å redusere den kinetiske energien til systemet, avkjøler vi det.
Dette konseptet betyr den kinetiske energien til partiklene som danner de omkringliggende kroppene, som gjenspeiler hastigheten til den kaotiske bevegelsen til partiklene. Jo større den er, jo høyere temperatur. Følgelig, ved å redusere den kinetiske energien til systemet, avkjøler vi det.
Termodynamisk temperatur uttrykkes i SI (International System of Units) i Kelvin (til ære for den britiske forskeren William Kelvin, som først foreslo denne skalaen). Å forstå termodynamikkens første, andre og tredje lov er umulig uten en definisjon av temperatur.
En deling av én grad på Kelvin-skalaen tilsvarer også én grad Celsius. Konverteringen mellom disse enhetene utføres i henhold til formelen: TK =TC + 273, 15, hvor TK og TC - temperaturer i henholdsvis kelvin og grader Celsius.
Det særegne med Kelvin-skalaen er at den ikke har negative verdier. Null i den (TC=-273, 15 oC) tilsvarer tilstanden når den termiske bevegelsen til partiklene i systemet er helt fraværende, ser de ut til å være "frosset".
Bevaring av energi og termodynamikkens første lov

I 1824 kom Nicolas Léonard Sadi Carnot, en fransk ingeniør og fysiker, med et dristig forslag som ikke bare førte til utviklingen av fysikk, men også ble et stort skritt i forbedringen av teknologien. Hanskan formuleres som følger: "Energi kan ikke skapes eller ødelegges, den kan bare overføres fra en stat til en annen."
Faktisk postulerer Sadi Carnots setning loven om bevaring av energi, som dannet grunnlaget for termodynamikkens første lov: "Når et system mottar energi fra utsiden, konverterer det det til andre former, de viktigste av som er termiske og mekaniske."
Den matematiske formelen for 1. lov er skrevet som følger:
Q=ΔU + A, her Q er mengden varme som overføres av omgivelsene til systemet, ΔU er endringen i den interne energien til dette systemet, A er det perfekte mekaniske arbeidet.
Adiabatiske prosesser
Et godt eksempel på dem er bevegelsen av luftmasser langs fjellskråninger. Slike masser er enorme (kilometer eller mer), og luft er en utmerket varmeisolator. De bemerkede egenskapene gjør at vi kan betrakte alle prosesser med luftmasser som skjer innen kort tid som adiabatiske. Når luft stiger opp en fjellskråning, faller trykket, det utvider seg, det vil si at det utfører mekanisk arbeid, og som et resultat avkjøles det. Tvert imot, nedadgående bevegelse av luftmassen er ledsaget av en økning i trykket i den, den komprimeres og blir på grunn av dette veldig varm.
Anvendelsen av termodynamikkens lov, som ble diskutert i forrige underoverskrift, demonstreres enklest ved å bruke eksemplet på en adiabatisk prosess.
I henhold til definisjonen, som et resultat av det er det ingen utveksling av energi medmiljø, det vil si i ligningen ovenfor, Q=0. Dette fører til følgende uttrykk: ΔU=-A. Minustegnet her betyr at systemet utfører mekanisk arbeid ved å redusere sin egen indre energi. Det bør huskes at den interne energien er direkte avhengig av temperaturen i systemet.
Retning av termiske prosesser
Denne utgaven omhandler termodynamikkens andre lov. Alle la sikkert merke til at hvis du bringer to gjenstander med forskjellige temperaturer i kontakt, vil den kalde alltid varme opp, og den varme vil avkjøles. Merk at den omvendte prosessen kan skje innenfor rammen av termodynamikkens første lov, men den blir aldri implementert i praksis.
Årsaken til irreversibiliteten til denne prosessen (og alle kjente prosesser i universet) er overgangen til systemet til en mer sannsynlig tilstand. I det betraktede eksemplet med kontakt mellom to legemer med forskjellige temperaturer, vil den mest sannsynlige tilstanden være den der alle partikler i systemet vil ha samme kinetiske energi.
Den andre loven for termodynamikk kan formuleres som følger: "Varme kan aldri spontant overføres fra en kald kropp til en varm." Hvis vi introduserer begrepet entropi som et mål på uorden, så kan det representeres som følger: "Enhver termodynamisk prosess fortsetter med en økning i entropi".
Varmemotor

Dette begrepet forstås som et system som på grunn av tilførsel av ekstern energi til det kan utføre mekanisk arbeid. Førstvarmemotorer var dampmaskiner og ble oppfunnet på slutten av 1600-tallet.
Den andre loven for termodynamikk spiller en avgjørende rolle for å bestemme effektiviteten. Sadi Carnot har også fastslått at maksimal effektivitet for denne enheten er: Effektivitet=(T2 - T1)/T2, her er T2 og T1 varmeapparat- og kjøleskapstemperaturer. Mekanisk arbeid kan bare utføres når det er en strøm av varme fra en varm kropp til en kald, og denne strømmen kan ikke 100 % omdannes til nyttig energi.
Figuren nedenfor viser driftsprinsippet for en varmemotor (Qabs - varme overført til maskinen, Qced - varmetap, W - nyttig arbeid, P og V - trykk og gassvolum i stempelet).
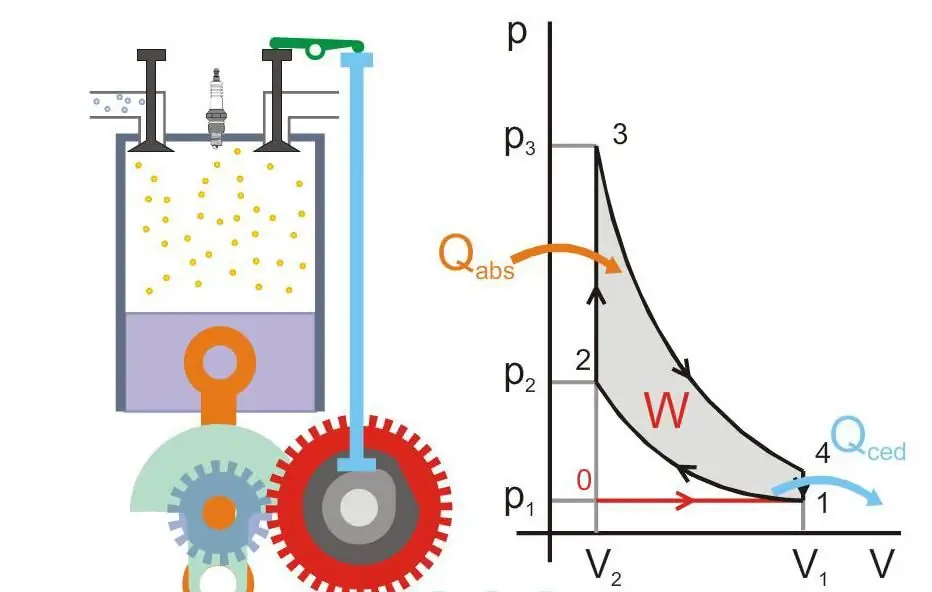
Absolutt null og Nernsts postulat
Til slutt, la oss gå videre til betraktningen av termodynamikkens tredje lov. Det kalles også Nernst-postulatet (navnet på den tyske fysikeren som først formulerte det på begynnelsen av 1900-tallet). Loven sier: "Absolutt null kan ikke nås med et begrenset antall prosesser." Det vil si at det er umulig på noen måte å fullstendig "fryse" molekylene og atomene til et stoff. Årsaken til dette er den konstante eksisterende varmevekslingen med omgivelsene.

En nyttig konklusjon trukket fra termodynamikkens tredje lov er at entropien avtar når man beveger seg mot absolutt null. Dette betyr at systemet har en tendens til å organisere seg selv. Dette faktum kanbruk for eksempel til å overføre paramagneter til en ferromagnetisk tilstand når de er avkjølt.
Det er interessant å merke seg at den laveste temperaturen som er nådd så langt er 5·10−10 K (2003, MIT laboratory, USA).






