Når man studerer oppførselen til gasser i fysikk, rettes mye oppmerksomhet mot isoprosesser, det vil si slike overganger mellom tilstandene i systemet, hvor én termodynamisk parameter er bevart. Det er imidlertid en gassovergang mellom stater, som ikke er en isoprosess, men som spiller en viktig rolle i natur og teknologi. Dette er en adiabatisk prosess. I denne artikkelen vil vi vurdere det mer detaljert, med fokus på hva den adiabatiske gasseksponenten er.
Adiabatisk prosess
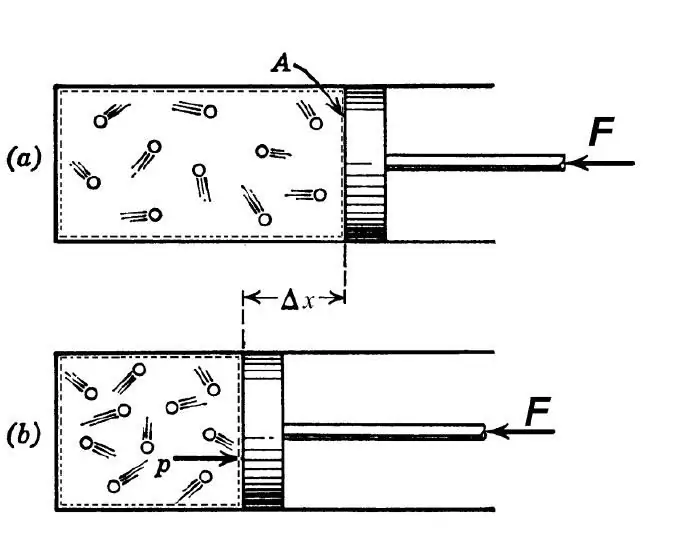
I henhold til den termodynamiske definisjonen forstås en adiabatisk prosess som en slik overgang mellom start- og slutttilstanden til systemet, som et resultat av at det ikke er noen varmeveksling mellom det ytre miljøet og systemet som studeres. En slik prosess er mulig under følgende to betingelser:
- varmeledningsevne mellom ytre miljø ogsystemet er lavt av en eller annen grunn;
- hastigheten på prosessen er høy, så varmevekslingen rekker ikke å finne sted.
I ingeniørfag brukes den adiabatiske overgangen både til å varme opp gassen under dens skarpe kompresjon, og til å avkjøle den under rask ekspansjon. I naturen manifesterer den aktuelle termodynamiske overgangen seg når en luftmasse stiger eller faller ned en åsside. Slike opp- og nedturer fører til endring av duggpunktet i luften og nedbør.
Poissons ligning for den adiabatiske idealgassen

En ideell gass er et system der partikler beveger seg tilfeldig i høye hastigheter, ikke samhandler med hverandre og er dimensjonsløse. En slik modell er veldig enkel når det gjelder dens matematiske beskrivelse.
I henhold til definisjonen av en adiabatisk prosess kan følgende uttrykk skrives i samsvar med termodynamikkens første lov:
dU=-PdV.
Med andre ord, en gass, som ekspanderer eller trekker seg sammen, virker PdV på grunn av en tilsvarende endring i dens indre energi dU.
I tilfellet med en ideell gass, hvis vi bruker tilstandsligningen (Clapeyron-Mendeleev-loven), kan vi få følgende uttrykk:
PVγ=const.
Denne likheten kalles Poisson-ligningen. Folk som er kjent med gassfysikk vil legge merke til at hvis verdien av γ er lik 1, vil Poisson-ligningen gå inn i Boyle-Mariotte-loven (isotermiskprosess). Imidlertid er en slik transformasjon av ligningene umulig, siden γ for enhver type ideell gass er større enn én. Mengden γ (gamma) kalles den adiabatiske indeksen til en ideell gass. La oss se nærmere på dens fysiske betydning.
Hva er den adiabatiske eksponenten?
Eksponenten γ, som vises i Poisson-ligningen for en ideell gass, er forholdet mellom varmekapasitet ved konstant trykk og samme verdi, men allerede ved konstant volum. I fysikk er varmekapasitet mengden varme som må overføres til eller tas fra et gitt system for at det skal endre temperaturen med 1 Kelvin. Vi vil betegne den isobariske varmekapasiteten med symbolet CP, og den isokoriske varmekapasiteten med symbolet CV. Da gjelder likheten for γ:
γ=CP/CV.
Siden γ alltid er større enn én, viser den hvor mange ganger den isobariske varmekapasiteten til det studerte gasssystemet overskrider den tilsvarende isokoriske karakteristikken.
Varmekapasitet til CP og CV
For å bestemme den adiabatiske eksponenten bør man ha god forståelse for betydningen av mengdene CP og CV. For å gjøre dette skal vi gjennomføre følgende tankeeksperiment: forestill deg at gassen er i et lukket system i et kar med solide vegger. Hvis fartøyet er oppvarmet, vil all den kommuniserte varmen ideelt sett omdannes til den indre energien til gassen. I en slik situasjon vil likhet være gyldig:
dU=CVdT.
VerdiCVdefinerer mengden varme som må overføres til systemet for å varme det isokorisk med 1 K.
Anta nå at gassen er i et fartøy med et bevegelig stempel. I prosessen med å varme opp et slikt system, vil stempelet bevege seg, noe som sikrer at et konstant trykk opprettholdes. Siden entalpien til systemet i dette tilfellet vil være lik produktet av den isobariske varmekapasiteten og endringen i temperatur, vil termodynamikkens første lov ha formen:
CPdT=CVdT + PdV.
Herfra kan man se at CP>CV, siden det i tilfelle av isobarisk endring av tilstander er nødvendig å bruke varme ikke bare for å øke temperaturen i systemet, og dermed dets indre energi, men også arbeidet som gjøres av gassen under dets ekspansjon.
Verdien av γ for en ideell monoatomisk gass
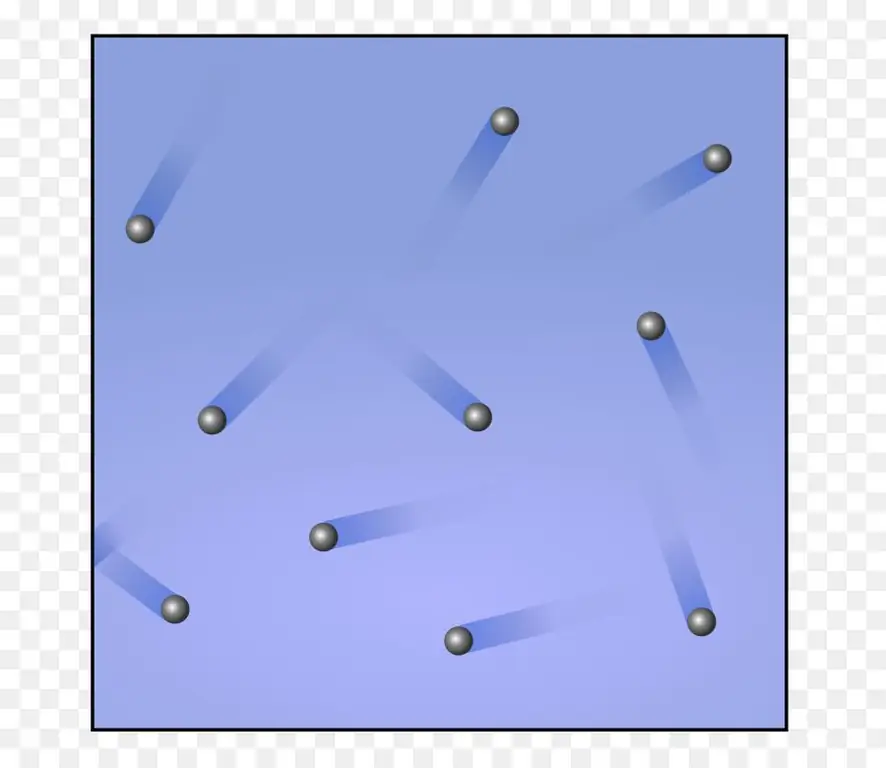
Det enkleste gasssystemet er en monoatomisk ideell gass. Anta at vi har 1 mol av en slik gass. Husk at i prosessen med isobarisk oppvarming av 1 mol gass med bare 1 Kelvin, fungerer det lik R. Dette symbolet brukes ofte for å betegne den universelle gasskonstanten. Det er lik 8, 314 J / (molK). Ved å bruke det siste uttrykket i forrige avsnitt for dette tilfellet får vi følgende likhet:
CP=CV+ R.
Hvorfra du kan bestemme verdien av isokorisk varmekapasitet CV:
γ=CP/CV;
CV=R/(γ-1).
Det er kjent for én føflekkmonatomisk gass, verdien av den isokoriske varmekapasiteten er:
CV=3/2R.
Fra de to siste likhetene følger verdien av den adiabatiske eksponenten:
3/2R=R/(γ-1)=>
γ=5/3 ≈ 1, 67.
Merk at verdien av γ utelukkende avhenger av de indre egenskapene til selve gassen (av den polyatomiske naturen til molekylene) og ikke avhenger av mengden stoff i systemet.
Avhengighet av γ av antall frihetsgrader
Ligningen for den isokoriske varmekapasiteten til en monoatomisk gass ble skrevet ovenfor. Koeffisienten 3/2 som dukket opp i den er relatert til antall frihetsgrader i ett atom. Den har evnen til å bevege seg bare i én av de tre retningene i rommet, det vil si at det kun er translasjonsgrader av frihet.
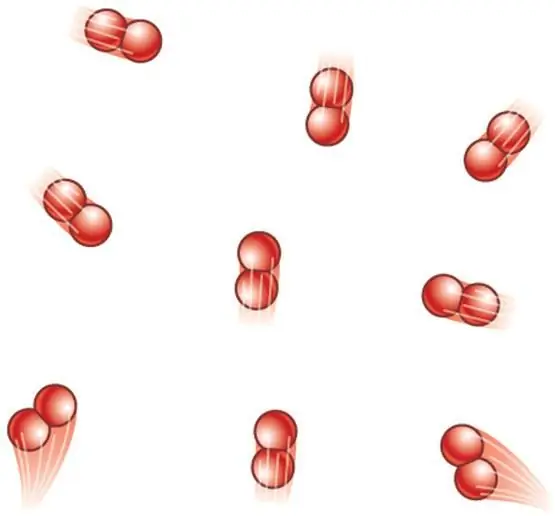
Hvis systemet er dannet av diatomiske molekyler, legges ytterligere to rotasjonsgrader til de tre translasjonsgrader. Derfor blir uttrykket for CV:
CV=5/2R.
Da vil verdien av γ være:
γ=7/5=1, 4.
Merk at det diatomiske molekylet faktisk har enda en vibrasjonsfrihetsgrad, men ved temperaturer på flere hundre Kelvin aktiveres det ikke og bidrar ikke til varmekapasiteten.
Hvis gassmolekyler består av mer enn to atomer, vil de ha 6 frihetsgrader. Den adiabatiske eksponenten i dette tilfellet vil være lik:
γ=4/3 ≈ 1, 33.
SåDermed, når antallet atomer i et gassmolekyl øker, synker verdien av γ. Hvis du bygger en adiabatisk graf i P-V-aksene, vil du legge merke til at kurven for en monoatomisk gass vil oppføre seg skarpere enn for en polyatomisk.
Adiabatisk eksponent for en blanding av gasser
Vi har vist ovenfor at verdien av γ ikke er avhengig av den kjemiske sammensetningen av gasssystemet. Det avhenger imidlertid av antall atomer som utgjør molekylene. La oss anta at systemet består av N komponenter. Atomfraksjonen av komponent i i blandingen er eni. Deretter, for å bestemme den adiabatiske eksponenten til blandingen, kan du bruke følgende uttrykk:
γ=∑i=1N(aiγ i).
Hvor γi er γ-verdien for den i-te komponenten.
For eksempel kan dette uttrykket brukes til å bestemme γ for luft. Siden den består av 99 % diatomiske molekyler av oksygen og nitrogen, bør dens adiabatiske indeks være svært nær verdien på 1,4, noe som bekreftes av den eksperimentelle bestemmelsen av denne verdien.






